La idea es muy simple. Coloco una sustancia radiactiva que emita partículas alfa y veo que hacen estas al incidir sobre la láminas. Siguiendo el modelo de Thomson, la mayoría deberían atravesarlas sin problemas pues la masa y la carga positiva de los atómos estaba repartida en su cuerpo esférico. Sin embargo lo que encontraron fue sorprendente, ya que algunas partículas se desviaban bastante e incluso algunas rebotaban. Esto era incompatible con el modelo del “plum pudding”.
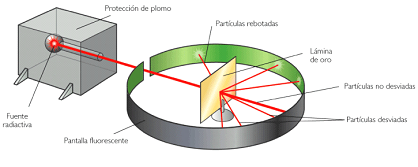
(Imagen tomada de http://ar.kalipedia.com)
La única explicación posible era aquellos resultados era considerar que la mayor parte de la masa (99,9 %) y toda la carga positiva del átomo estaba concentrada en un muy pequeño y denso volumen en el centro del átomo. El propio Rutherford llamó núcleo a esa zona siguiendo la denominación dada años antes al centro de las células. Unos años más tarde el físico neozelandés descubriría los protones como formantes de esos núcleos, y aún más tarde otro físico británico, James Chadwick, descubriría las otras partículas formantes: los neutrones. Pero esta es otra historia.
Poco después de su experimento con las partículas alfa llegó al laboratorio Cavendish un joven físico danés: Niels Bohr. El sería el “encargado” de demostrar que los electrones giraban en órbitas determinadas alrededor del núcleo de Rutherford. La imagen del átomo, que todavía hoy sigue siendo la más popular, estaba completa.
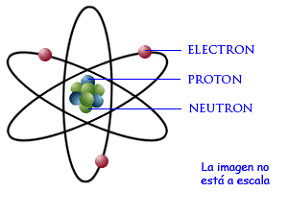
(Imagen tomada de http://www.portierramaryaire.com/arts/teorianuclear_1.php)